Dịch vụ công bố tiêu chuẩn Bộ phụ kiện dùng trong tán sỏi thận qua da
Ngày 23/09/2024 - 06:09Trang thiết bị y tế công bố tiêu chuẩn áp dụng:
- Tên trang thiết bị y tế: Bộ phụ kiện dùng trong tán sỏi thận qua da
- Tên thương mại (nếu có):
- Mã Global Medical Device Nomenclature - GMDN (nếu có):
- Chủng loại:
- Mã sản phẩm:
- Quy cách đóng gói (nếu có):
- Loại trang thiết bị y tế: TTBYT Loại B
- Mục đích sử dụng: Sử dụng trong chuẩn đoán và phẫu thuật nội soi
- Tên cơ sở sản xuất:
- Địa chỉ cơ sở sản xuất:
- Tiêu chuẩn chất lượng sản phẩm áp dụng: ISO 13485

Giới thiệu
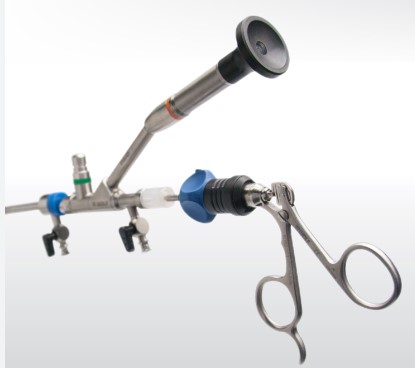
Bộ phụ kiện dùng trong tán sỏi thận qua da là một giải pháp y tế hiện đại, được thiết kế để hỗ trợ quá trình điều trị sỏi thận hiệu quả và an toàn. Với các dụng cụ chuyên dụng như ống dẫn, máy tán sỏi, và các thiết bị hỗ trợ khác, bộ phụ kiện này giúp bác sĩ thực hiện quy trình tán sỏi một cách chính xác và nhanh chóng. Để đưa bộ sản phẩm này vào lưu hành tại thị trường Việt Nam, việc công bố sản phẩm là điều cần thiết.
Tại sao cần công bố sản phẩm?
Tuân thủ quy định pháp lý: Việt Nam có hệ thống quy định nghiêm ngặt đối với thiết bị y tế. Việc công bố sản phẩm giúp đảm bảo rằng bộ phụ kiện tán sỏi thận qua da đáp ứng đầy đủ các tiêu chuẩn về chất lượng, an toàn và hiệu quả theo quy định của Bộ Y tế.
Bảo vệ quyền lợi người tiêu dùng: Công bố sản phẩm sẽ cung cấp thông tin chi tiết về tính năng, công dụng, cách sử dụng và các hướng dẫn an toàn. Điều này giúp các cơ sở y tế và bệnh nhân lựa chọn sản phẩm phù hợp và an toàn cho quá trình điều trị.
Tăng cường sự tin tưởng từ thị trường: Một sản phẩm đã được công bố và kiểm định chất lượng sẽ tạo ra sự tin tưởng từ phía bác sĩ, nhân viên y tế và bệnh nhân. Điều này không chỉ nâng cao uy tín của sản phẩm mà còn tạo điều kiện thuận lợi cho việc mở rộng thị trường.
Các bước công bố sản phẩm
Chuẩn bị hồ sơ: Hồ sơ cần bao gồm thông tin chi tiết về thiết kế, thành phần, nguyên lý hoạt động, quy trình sản xuất và các chứng nhận an toàn liên quan.
Đăng ký sản phẩm: Nộp hồ sơ công bố sản phẩm tại cơ quan chức năng có thẩm quyền. Thời gian xem xét và phê duyệt hồ sơ thường kéo dài từ 30 đến 60 ngày.
Nhận giấy chứng nhận: Sau khi hồ sơ được phê duyệt, sản phẩm sẽ nhận được giấy chứng nhận công bố, cho phép bộ phụ kiện tán sỏi thận qua da được phân phối trên thị trường.
Tiếp thị và quảng bá: Khi đã có giấy chứng nhận, nhà sản xuất có thể triển khai các hoạt động marketing để giới thiệu sản phẩm đến các bệnh viện, phòng khám và người tiêu dùng, nhấn mạnh vào các lợi ích và ứng dụng của bộ phụ kiện trong quá trình điều trị sỏi thận.
Kết luận
Bộ phụ kiện dùng trong tán sỏi thận qua da là sản phẩm thiết yếu trong việc nâng cao chất lượng dịch vụ y tế, mang lại hiệu quả cao trong điều trị sỏi thận. Để sản phẩm có thể ra mắt thành công tại thị trường Việt Nam, việc công bố sản phẩm là bước đi không thể thiếu. Điều này không chỉ đảm bảo tuân thủ các quy định pháp luật mà còn bảo vệ quyền lợi người tiêu dùng, đồng thời xây dựng niềm tin và uy tín cho thương hiệu trong lĩnh vực y tế.










