Chương trình thông báo GRAS của FDA Hoa Kỳ hoạt động như thế nào
Ngày 29/07/2024 - 09:07Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) quản lý khoảng 80% nguồn cung cấp thực phẩm của Hoa Kỳ và tham gia vào nhiều khía cạnh của an toàn thực phẩm.
Trong FDA, Văn phòng An toàn Phụ gia Thực phẩm của Trung tâm An toàn Thực phẩm và Dinh dưỡng Ứng dụng (CFSAN) chịu trách nhiệm xem xét thông tin an toàn cho các thành phần thực phẩm và bao bì thực phẩm. Bài viết này cung cấp tổng quan về một loại phân loại quy định thành phần thực phẩm cụ thể: 'nói chung được công nhận là an toàn', thường được gọi là GRAS. Bài viết mô tả lịch sử của chương trình GRAS, cách Văn phòng An toàn Phụ gia Thực phẩm quản lý chương trình và bao gồm số liệu thống kê về chương trình.
Năm 1958, Quốc hội đã ban hành Tu chính án Phụ gia thực phẩm cho Đạo luật Thực phẩm, Dược phẩm và Mỹ phẩm Liên bang (Đạo luật FD&C). Tu chính án và/hoặc các văn bản lập pháp hỗ trợ đã định nghĩa thuật ngữ 'phụ gia thực phẩm'; yêu cầu phê duyệt trước khi đưa ra thị trường đối với các mục đích sử dụng mới của phụ gia thực phẩm; và thiết lập tiêu chuẩn đánh giá ('đánh giá công bằng dữ liệu...'), tiêu chuẩn an toàn và các thủ tục ban hành quy định chính thức đối với phụ gia thực phẩm. Quốc hội định nghĩa rộng rãi 'phụ gia thực phẩm' bao gồm bất kỳ chất nào mà mục đích sử dụng dự kiến dẫn đến hoặc có thể được mong đợi một cách hợp lý sẽ dẫn đến, trực tiếp hoặc gián tiếp, việc trở thành một thành phần hoặc ảnh hưởng theo cách khác đến thành phần của thực phẩm. Quốc hội tuyên bố thêm rằng 'các chất được công nhận chung, trong số các chuyên gia có trình độ đào tạo khoa học và kinh nghiệm để đánh giá tính an toàn của chúng là đã được chứng minh đầy đủ... là an toàn trong các điều kiện sử dụng dự kiến', bị loại khỏi định nghĩa. Nói một cách đơn giản, các chất được GRAS theo các điều kiện sử dụng dự kiến của chúng không phải là phụ gia thực phẩm và không cần FDA chấp thuận trước khi đưa ra thị trường.
Xác định GRAS so với Xác định an toàn phụ gia thực phẩm
Bất kể một chất có được coi là GRAS hay tính an toàn của nó được thiết lập thông qua quy trình phê duyệt trước khi đưa ra thị trường, thì việc xác định tính an toàn luôn bị giới hạn trong các điều kiện sử dụng dự kiến của chất đó. [1] Sự khác biệt giữa xác định GRAS và phê duyệt trước khi đưa ra thị trường liên quan đến việc ai có quyền truy cập vào dữ liệu và thông tin khoa học và ai đã xem xét dữ liệu và thông tin khoa học.
Để một chất được GRAS, dữ liệu khoa học và thông tin về việc sử dụng chất đó phải được biết đến rộng rãi và phải có sự đồng thuận giữa các chuyên gia đủ tiêu chuẩn rằng dữ liệu và thông tin đó chứng minh rằng chất đó an toàn trong các điều kiện sử dụng dự kiến. Các xác định GRAS được thực hiện theo cách này được cho là được thực hiện thông qua các quy trình khoa học. Đối với một chất phụ gia thực phẩm, dữ liệu và thông tin do cá nhân nắm giữ về việc sử dụng một chất được nhà tài trợ gửi đến FDA, nơi sẽ đánh giá các dữ liệu và thông tin đó để xác định xem chúng có chứng minh rằng chất đó an toàn trong các điều kiện sử dụng dự kiến hay không (21 CFR 171.1). Do đó, đối với một chất phụ gia thực phẩm, FDA xác định tính an toàn của thành phần; trong khi việc xác định một thành phần là GRAS có thể được đưa ra bởi các chuyên gia đủ tiêu chuẩn bên ngoài chính phủ.
Tuy nhiên, có một cách khác để xác định GRAS. Đối với một chất được sử dụng trong thực phẩm trước năm 1958, xác định GRAS có thể được thực hiện thông qua kinh nghiệm dựa trên việc sử dụng phổ biến trong thực phẩm. Cần lưu ý rằng việc xác định dựa trên việc sử dụng phổ biến trong thực phẩm đòi hỏi phải có lịch sử tiêu thụ đáng kể trong thực phẩm của một số lượng lớn người tiêu dùng (21 CFR 170.30(c) và 170.3(f)), và cơ sở này để xác định GRAS hiếm khi được dựa vào ngày nay.
Khẳng định GRAS
Vào cuối những năm 1960, thông tin khoa học mới đã đặt ra câu hỏi về tính an toàn của muối cyclamate, các chất trước đây được coi là GRAS. Do đó, khi đó là Tổng thống Nixon đã chỉ đạo FDA xem xét lại tính an toàn của các chất được coi là GRAS. Để đáp lại chỉ thị này, FDA đã thông báo rằng cơ quan này sẽ đánh giá, theo các tiêu chuẩn đương thời của thời điểm đó, thông tin an toàn có sẵn liên quan đến các chất mà FDA coi là GRAS. Nếu đánh giá xác nhận rằng việc sử dụng một chất cụ thể là GRAS, FDA sẽ ban hành một quy định GRAS mới, khẳng định phát hiện đó. Là một phần của quy trình khẳng định GRAS, FDA cũng đã thiết lập các thủ tục theo đó các cá nhân có thể gửi đơn yêu cầu FDA xem xét lại tình trạng GRAS của các chất không được đề cập trong phạm vi đánh giá GRAS mà cơ quan này đã thực hiện khi thông qua Tu chính án về Phụ gia Thực phẩm năm 1958.
Đến năm 1997, FDA đã tạm thời kết luận rằng họ không thể tiếp tục dành nhiều nguồn lực cho quy trình kiến nghị xác nhận GRAS. Cơ quan này đã công bố một quy định được đề xuất nêu rõ quy trình thông báo GRAS để thay thế quy trình kiến nghị xác nhận GRAS tốn nhiều nguồn lực. [2] Là một phần của quy định được đề xuất, cơ quan này đã công bố một chính sách tạm thời, theo đó FDA sẽ chấp nhận và quản lý chung các thông báo GRAS như được mô tả trong quy định được đề xuất, cho đến khi quy định cuối cùng được công bố. Theo chính sách tạm thời, FDA cho biết họ sẽ nỗ lực thiện chí để tuân thủ các mốc thời gian được nêu trong quy định được đề xuất; tuy nhiên, cơ quan này sẽ không bị ràng buộc bởi các mốc thời gian đó. Năm 1998, FDA đã nhận được thông báo GRAS đầu tiên cho một thành phần thực phẩm.
Chương trình thông báo GRAS
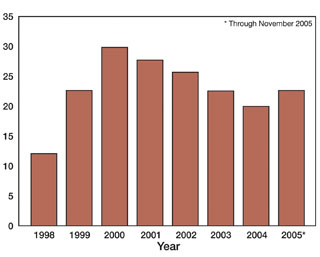
Chương trình thông báo GRAS cung cấp một cơ chế tự nguyện theo đó một người có thể thông báo cho FDA về quyết định rằng việc sử dụng một chất là GRAS, thay vì kiến nghị FDA khẳng định rằng việc sử dụng một chất là GRAS. Mặc dù hoạt động theo một quy trình tạm thời, trong khi chờ công bố quy tắc cuối cùng, FDA đã nhận và phản hồi gần 200 thông báo GRAS cho nhiều loại chất bao gồm carbohydrate, lipid, protein và các hóa chất như khí, chất vô cơ, chất hữu cơ (Hình 1 và 2).
Hình 1. Số lượng thông báo GRAS được nộp theo năm, từ năm 1998 đến tháng 11 năm 2005.
Hình 2. Các loại chất đã được nộp thông báo GRAS.
Nộp thông báo GRAS
FDA khuyến khích các cá nhân xem xét kỹ lưỡng các thủ tục gửi thông báo GRAS của mình trước khi gửi thông báo cho Cơ quan. [3] Ngoài ra, người thông báo có thể yêu cầu họp trước khi gửi với FDA để thảo luận về các vấn đề có thể liên quan đến việc gửi thông báo GRAS của người thông báo.
Thông báo phải được gửi đến Văn phòng An toàn Phụ gia Thực phẩm của FDA và trong số nhiều thứ khác bao gồm: 'yêu cầu miễn trừ GRAS' cung cấp mô tả ngắn gọn về chất, các điều kiện sử dụng áp dụng và cơ sở cho việc xác định GRAS (quy trình khoa học hoặc sử dụng phổ biến trong thực phẩm). Thông báo cũng phải bao gồm thông tin về danh tính và đặc tính của chất và thảo luận về lý do của người thông báo khi kết luận rằng chất là GRAS cho mục đích sử dụng dự kiến của nó. Thông tin về chất được thông báo thường có bản chất là hóa học, độc tính và nếu có thể, vi sinh. Người thông báo phải thảo luận về thông tin hỗ trợ cho việc xác định GRAS, cũng như bất kỳ thông tin nào có vẻ không nhất quán với việc xác định GRAS và giải thích lý do tại sao, xét theo tổng thể thông tin, người thông báo kết luận rằng chất là GRAS theo các điều kiện sử dụng dự kiến.
Phản hồi của FDA
Trong vòng 30 ngày kể từ ngày nhận được thông báo, FDA sẽ thông báo cho người thông báo bằng văn bản về ngày nhận được thông báo. Sau đó, FDA đánh giá xem thông báo đã nộp có cung cấp đủ cơ sở để xác định GRAS hay không và liệu thông tin trong thông báo, hoặc thông tin mà FDA có, có nêu ra các vấn đề khiến cơ quan này phải đặt câu hỏi liệu việc sử dụng chất đó có phải là GRAS hay không. Đôi khi, FDA sẽ tham khảo ý kiến của các cơ quan khác; ví dụ, khi thông báo bao gồm việc sử dụng trong các sản phẩm thịt và gia cầm, FDA sẽ tham khảo ý kiến của Cơ quan Kiểm tra và An toàn Thực phẩm thuộc Bộ Nông nghiệp Hoa Kỳ.
Sau khi đánh giá này, FDA trả lời người thông báo bằng một trong ba loại thư. Loại thư đầu tiên nêu rằng FDA không đặt câu hỏi về cơ sở cho quyết định GRAS của người thông báo. Loại thư này cũng có thể lưu ý, trong số những thứ khác, các vấn đề có thể liên quan đến nhãn, việc sử dụng chất trong một số loại thực phẩm và các yêu cầu đối với chất phụ gia màu. [4] Trong loại thư thứ hai, cơ quan kết luận rằng thông báo không cung cấp đủ cơ sở cho quyết định GRAS (ví dụ, vì thông báo không bao gồm dữ liệu và thông tin phù hợp hoặc vì dữ liệu và thông tin có sẵn đặt ra câu hỏi về tính an toàn của chất được thông báo). Loại thư thứ ba nêu rằng cơ quan đã, theo yêu cầu của người thông báo, ngừng đánh giá thông báo GRAS.
Là một phần của đề xuất GRAS năm 1997, FDA cũng đã công bố ý định duy trì một bản kiểm kê các thông báo GRAS và phản hồi của cơ quan đối với các thông báo đó. Theo đó, Văn phòng An toàn Phụ gia Thực phẩm đã tạo và duy trì một trang web có tiêu đề 'Tóm tắt Tất cả các Thông báo GRAS. [5] Trang này liệt kê tất cả các thông báo GRAS mà FDA đã nhận được, mô tả các phản hồi của FDA và cung cấp các siêu liên kết đến các thư phản hồi của FDA và các thư từ bổ sung. Trang được sắp xếp theo năm và trong bảng tóm tắt của mỗi năm, có một liên kết đến một bảng cung cấp thêm thông tin chi tiết về các thông báo GRAS đã nhận được trong năm đó, bao gồm: tên của người đưa ra quyết định GRAS (người thông báo); chất là đối tượng của thông báo; mô tả về mục đích sử dụng dự kiến của chất đó; cơ sở cho quyết định GRAS; và phản hồi của FDA đối với thông báo.
FDA khuyến khích những cá nhân đang cân nhắc nộp thông báo GRAS hoặc chỉ muốn biết thêm về các chất GRAS hãy xem trang web Chương trình thông báo GRAS của CFSAN và tài liệu 'Câu hỏi thường gặp về GRAS' trên trang đó. Thông tin về các chương trình khác thuộc phạm vi của Văn phòng An toàn phụ gia thực phẩm của CFSAN có thể được tìm thấy tại Ingredients and Packaging .
Tiến sĩ Paulette Gaynor là một viên chức an toàn cho người tiêu dùng tại Văn phòng An toàn Phụ gia Thực phẩm của CFSAN, Bộ phận Công nghệ sinh học và Đánh giá Thông báo GRAS. Bà đã làm việc cho FDA trong chín năm và hiện đang là người liên hệ cho chương trình thông báo GRAS.
Biên tập viên Sebastian Cianci là một nhà phân tích chính sách và là thành viên của Văn phòng An toàn thực phẩm, Quốc phòng và Tiếp cận cộng đồng của CFSAN. Ông đã làm việc cho FDA trong 15 năm và là nhân viên liên lạc báo chí thương mại của Trung tâm.
Chú thích cuối trang
1. FDA đã định nghĩa "an toàn" là "sự chắc chắn hợp lý trong tâm trí của các nhà khoa học có năng lực rằng chất này không gây hại trong các điều kiện sử dụng dự kiến" (21 CFR 170.3(i).
2. 62 FR 18938, ngày 17 tháng 4 năm 1997 (PDF - 272KB) . Các chất được công nhận chung là an toàn.
3. Cách nộp thông báo GRAS .
4. Theo mục 201(s) của Đạo luật FD&C, các chất GRAS bị loại khỏi định nghĩa về phụ gia thực phẩm. Không có loại trừ tương ứng nào trong định nghĩa về phụ gia màu (mục 201(t) của Đạo luật FD&C). Với sự khác biệt này, việc sử dụng một chất có khả năng tạo màu có thể cấu thành việc sử dụng như một phụ gia màu và như một phụ gia thực phẩm hoặc chất GRAS.
5. Tóm tắt tất cả các thông báo của GRAS .