Dịch vụ công bố tiêu chuẩn Đầu dò siêu âm trong buồng tim
Ngày 18/09/2024 - 04:09Trang thiết bị y tế đăng ký lưu hành:
- Tên trang thiết bị y tế: Đầu dò siêu âm trong buồng tim
- Tên thương mại (nếu có):
- Mã Global Medical Device Nomenclature - GMDN (nếu có):
- Chủng loại:
- Mã sản phẩm:
- Quy cách đóng gói (nếu có):
- Loại trang thiết bị y tế: TTBYT Loại D
- Mục đích sử dụng: Được chỉ định sử dụng cho bệnh nhân là người lớn và thanh thiếu niên để hình dung cấu trúc tim, lưu lượng máu và các thiết bị khác trong tim.
- Tên cơ sở sản xuất:
- Địa chỉ cơ sở sản xuất:

Đầu dò siêu âm trong buồng tim là gì?
Đầu dò siêu âm trong buồng tim (Intracardiac Echocardiography – ICE) là một thiết bị y tế được sử dụng trong các thủ thuật can thiệp tim mạch, như cấy máy tạo nhịp tim, sửa chữa van tim hoặc điều trị các rối loạn nhịp tim. Thiết bị này có thể phát hiện và đánh giá chính xác các cấu trúc bên trong buồng tim thông qua việc tạo ra hình ảnh siêu âm chi tiết, giúp bác sĩ nhìn rõ các bộ phận của tim trong quá trình can thiệp.
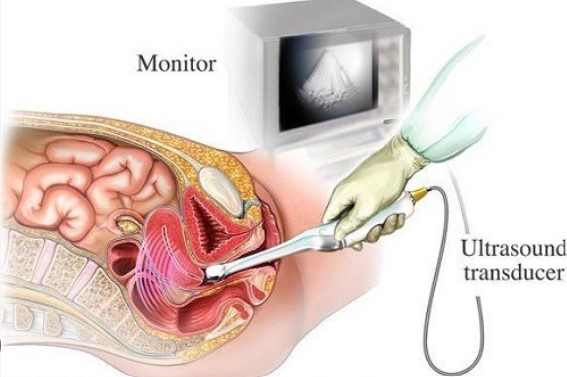
Đặc điểm của đầu dò siêu âm trong buồng tim:
Hình ảnh độ phân giải cao: Đầu dò siêu âm này có khả năng cung cấp hình ảnh rõ nét và chi tiết của các cấu trúc bên trong buồng tim, bao gồm van tim, màng tim, vách tim, và động mạch vành.
Tính xâm lấn tối thiểu: Đầu dò siêu âm được đưa vào buồng tim qua các đường tiếp cận xâm lấn tối thiểu, thường qua tĩnh mạch hoặc động mạch lớn, giúp giảm thiểu đau đớn và rủi ro cho bệnh nhân so với các phương pháp khác.
Hỗ trợ các thủ thuật tim mạch: Thiết bị này được sử dụng trong các thủ thuật phức tạp như đặt stent, cấy máy tạo nhịp, và điều trị rối loạn nhịp tim. Nó cung cấp cho bác sĩ hình ảnh thời gian thực của buồng tim, từ đó giúp nâng cao độ chính xác trong quá trình phẫu thuật.
Ứng dụng trong y học:
Chẩn đoán và điều trị bệnh lý tim mạch: Đầu dò siêu âm trong buồng tim giúp phát hiện các vấn đề như hẹp van tim, suy tim, và bệnh tim bẩm sinh một cách chính xác và nhanh chóng.
Hỗ trợ can thiệp xâm lấn: Thiết bị này cung cấp hình ảnh chi tiết trong quá trình đặt máy tạo nhịp, thực hiện các thủ thuật thông tim, và điều trị các rối loạn nhịp tim.
Tại sao cần công bố sản phẩm đầu dò siêu âm trong buồng tim trước khi lưu hành tại Việt Nam?
Theo quy định tại Nghị định 36/2016/NĐ-CP của Chính phủ về quản lý trang thiết bị y tế, tất cả các thiết bị y tế, bao gồm đầu dò siêu âm trong buồng tim, cần phải trải qua quá trình công bố sản phẩm trước khi được phép lưu hành tại thị trường Việt Nam. Việc công bố sản phẩm là bước quan trọng để đảm bảo rằng các thiết bị được đưa ra thị trường đáp ứng đầy đủ các tiêu chuẩn về chất lượng, an toàn và hiệu quả.
Lý do cần công bố sản phẩm:
Đảm bảo an toàn cho bệnh nhân: Đầu dò siêu âm trong buồng tim là thiết bị có tính xâm lấn và được sử dụng trực tiếp trong các thủ thuật tim mạch phức tạp. Do đó, sản phẩm phải được kiểm tra nghiêm ngặt để đảm bảo không gây ra rủi ro hoặc biến chứng cho bệnh nhân.
Đảm bảo chất lượng điều trị: Một thiết bị không đạt chuẩn có thể ảnh hưởng nghiêm trọng đến chất lượng hình ảnh siêu âm, từ đó làm giảm độ chính xác trong quá trình chẩn đoán và điều trị. Việc công bố sản phẩm giúp xác nhận rằng thiết bị đáp ứng các tiêu chuẩn kỹ thuật cần thiết.
Tuân thủ quy định pháp luật: Công bố sản phẩm là yêu cầu bắt buộc của pháp luật Việt Nam đối với các thiết bị y tế. Việc không tuân thủ quy định có thể dẫn đến việc sản phẩm bị cấm lưu hành, thu hồi hoặc doanh nghiệp phải chịu các hình thức xử phạt hành chính.
Tăng cường lòng tin của người sử dụng: Việc công bố sản phẩm giúp các cơ sở y tế và người tiêu dùng tin tưởng hơn vào chất lượng và độ an toàn của sản phẩm. Điều này đặc biệt quan trọng trong lĩnh vực y tế, nơi tính mạng và sức khỏe của bệnh nhân luôn là ưu tiên hàng đầu.
Quy trình công bố sản phẩm đầu dò siêu âm trong buồng tim
Để đầu dò siêu âm trong buồng tim được phép lưu hành hợp pháp tại thị trường Việt Nam, các doanh nghiệp cần thực hiện quy trình công bố sản phẩm theo các bước sau:
Chuẩn bị hồ sơ công bố sản phẩm: Hồ sơ bao gồm các tài liệu kỹ thuật liên quan đến sản phẩm như mô tả chi tiết về cấu tạo, nguyên lý hoạt động, quy trình sản xuất, các chứng nhận về chất lượng và an toàn, cũng như các kết quả thử nghiệm lâm sàng chứng minh hiệu quả của sản phẩm.
Kiểm định chất lượng sản phẩm: Sản phẩm cần được kiểm định tại các cơ sở có thẩm quyền để đảm bảo đáp ứng tiêu chuẩn kỹ thuật và an toàn y tế trước khi đưa ra thị trường.
Nộp hồ sơ công bố sản phẩm: Doanh nghiệp nộp hồ sơ công bố sản phẩm lên cơ quan quản lý nhà nước như Bộ Y tế hoặc Sở Y tế để được xem xét và phê duyệt.
Nhận giấy phép lưu hành: Sau khi hồ sơ được phê duyệt, doanh nghiệp sẽ nhận được giấy phép lưu hành sản phẩm. Đây là điều kiện cần thiết để sản phẩm có thể được bán ra và sử dụng tại các bệnh viện, phòng khám trên toàn quốc.
Kết luận
Đầu dò siêu âm trong buồng tim là một thiết bị y tế tiên tiến, có vai trò quan trọng trong chẩn đoán và điều trị các bệnh lý tim mạch. Để đảm bảo rằng sản phẩm này đáp ứng các tiêu chuẩn về an toàn và chất lượng, việc công bố sản phẩm là một bước cần thiết và bắt buộc theo quy định của pháp luật Việt Nam.
Quá trình công bố sản phẩm không chỉ giúp đảm bảo an toàn cho người bệnh, mà còn tăng cường độ tin cậy đối với các cơ sở y tế sử dụng thiết bị. Đây cũng là cách giúp các doanh nghiệp sản xuất và phân phối thiết bị y tế xây dựng uy tín trên thị trường, đồng thời đảm bảo tuân thủ đúng quy định pháp lý trong nước.










