Dịch vụ công bố tiêu chuẩn Hệ thống đặt thủy tinh thể nhân tạo
Ngày 21/09/2024 - 02:09Trang thiết bị y tế công bố tiêu chuẩn áp dụng:
- Tên trang thiết bị y tế: Hệ thống đặt thủy tinh thể nhân tạo
- Tên thương mại (nếu có):
- Mã Global Medical Device Nomenclature - GMDN (nếu có):
- Chủng loại:
- Mã sản phẩm:
- Quy cách đóng gói (nếu có):
- Loại trang thiết bị y tế: TTBYT Loại B
- Mục đích sử dụng: Sản phẩm vô trùng sử dụng một lần nhằm mục đích gấp lại và hỗ trợ đưa thủy tinh thể nhân tạo vào bao thủy tinh thể của mắt trong phẫu thuật Phaco
- Tên cơ sở sản xuất:
- Địa chỉ cơ sở sản xuất:
- Tiêu chuẩn chất lượng sản phẩm áp dụng: Tiêu chuẩn của NSX

Giới thiệu
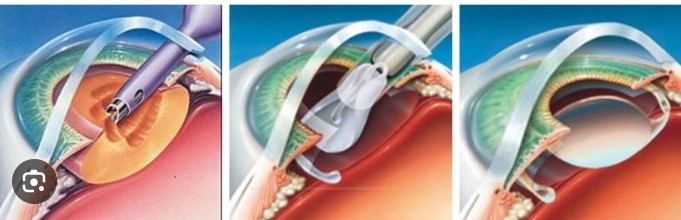
Thủy tinh thể nhân tạo là một thiết bị y tế quan trọng trong các ca phẫu thuật thay thủy tinh thể, đặc biệt đối với những bệnh nhân mắc bệnh đục thủy tinh thể hoặc các bệnh lý về mắt khác liên quan đến thủy tinh thể. Hệ thống đặt thủy tinh thể nhân tạo là một công cụ cần thiết giúp bác sĩ đưa thủy tinh thể nhân tạo vào vị trí chính xác trong mắt người bệnh, đảm bảo sự thành công của ca phẫu thuật.
Tại Việt Nam, theo quy định của Bộ Y tế, các sản phẩm thiết bị y tế như hệ thống đặt thủy tinh thể nhân tạo phải được công bố sản phẩm trước khi lưu hành trên thị trường. Điều này nhằm đảm bảo sản phẩm đạt tiêu chuẩn an toàn và hiệu quả, đồng thời tuân thủ đầy đủ các quy định pháp lý để bảo vệ người bệnh và các bác sĩ phẫu thuật.
Hệ thống đặt thủy tinh thể nhân tạo
Hệ thống đặt thủy tinh thể nhân tạo là một thiết bị phẫu thuật chuyên dụng, hỗ trợ việc thay thế thủy tinh thể bị tổn thương hoặc không còn chức năng bằng một thủy tinh thể nhân tạo mới. Thiết bị này giúp đưa thủy tinh thể nhân tạo vào mắt một cách an toàn và chính xác thông qua một vết rạch nhỏ. Quy trình này yêu cầu sự chính xác tuyệt đối, bởi sai lệch nhỏ cũng có thể ảnh hưởng đến thị lực và sự phục hồi của bệnh nhân.
Các thành phần chính của hệ thống đặt thủy tinh thể nhân tạo bao gồm:
Ống tiêm đặc biệt: Được thiết kế để đưa thủy tinh thể nhân tạo vào trong mắt qua một vết rạch nhỏ, giảm thiểu tổn thương cho các mô xung quanh.
Kim đặt thủy tinh thể: Giúp di chuyển thủy tinh thể đến vị trí chính xác trong khoang mắt, đảm bảo sự ổn định và phù hợp với cấu trúc mắt của bệnh nhân.
Công nghệ không xâm lấn: Giảm thiểu nguy cơ biến chứng và rút ngắn thời gian hồi phục sau phẫu thuật.
Tại sao hệ thống đặt thủy tinh thể nhân tạo cần công bố sản phẩm?
Công bố sản phẩm thiết bị y tế tại Việt Nam là một yêu cầu bắt buộc đối với mọi sản phẩm trước khi đưa ra thị trường. Điều này đảm bảo tính an toàn, hiệu quả và chất lượng của sản phẩm khi sử dụng trong các quy trình y tế nhạy cảm. Với hệ thống đặt thủy tinh thể nhân tạo, việc công bố sản phẩm là vô cùng cần thiết vì lý do sau:
Đảm bảo an toàn cho người bệnh: Hệ thống này tiếp xúc trực tiếp với các cấu trúc nhạy cảm trong mắt, do đó việc đảm bảo sản phẩm đạt tiêu chuẩn an toàn là điều tối quan trọng để tránh các biến chứng nguy hiểm cho thị lực và sức khỏe của bệnh nhân.
Tính chính xác và hiệu quả cao: Thủy tinh thể nhân tạo cần được đặt vào vị trí một cách chính xác để đảm bảo thị lực của bệnh nhân được phục hồi tốt nhất. Hệ thống này cần được kiểm định về khả năng chính xác và độ tin cậy.
Đáp ứng yêu cầu pháp lý: Theo quy định của Bộ Y tế Việt Nam, mọi thiết bị y tế trước khi lưu hành đều phải được công bố sản phẩm. Điều này giúp ngăn chặn việc lưu hành các sản phẩm kém chất lượng, không rõ nguồn gốc.
Giảm thiểu rủi ro cho bác sĩ và bệnh nhân: Sử dụng các thiết bị không đạt chuẩn có thể gây ra rủi ro trong quá trình phẫu thuật, ảnh hưởng đến uy tín của bác sĩ cũng như sức khỏe của bệnh nhân.
Quy trình công bố sản phẩm
Việc công bố hệ thống đặt thủy tinh thể nhân tạo cần tuân thủ đầy đủ quy trình do Bộ Y tế ban hành, nhằm đảm bảo sản phẩm đáp ứng các tiêu chuẩn về chất lượng và an toàn. Các bước chính trong quy trình công bố bao gồm:
Chuẩn bị hồ sơ công bố sản phẩm: Hồ sơ cần bao gồm các giấy tờ pháp lý liên quan đến nguồn gốc sản phẩm, tiêu chuẩn chất lượng và các chứng nhận quốc tế nếu có, chẳng hạn như CE Mark hoặc chứng nhận từ FDA.
Nộp hồ sơ lên Bộ Y tế: Sau khi chuẩn bị đầy đủ hồ sơ, nhà sản xuất hoặc đơn vị nhập khẩu cần nộp hồ sơ lên Cục Quản lý Dược và Thiết bị Y tế để xem xét và thẩm định.
Thẩm định sản phẩm: Bộ Y tế sẽ tiến hành thẩm định tính hợp lệ của sản phẩm và kiểm tra xem sản phẩm có đáp ứng các tiêu chuẩn an toàn và chất lượng theo quy định hay không.
Cấp phép lưu hành: Nếu sản phẩm đạt yêu cầu, Bộ Y tế sẽ cấp giấy phép lưu hành cho hệ thống đặt thủy tinh thể nhân tạo, cho phép sản phẩm được nhập khẩu và phân phối hợp pháp trên thị trường.
Lợi ích của việc công bố sản phẩm
Việc công bố sản phẩm không chỉ đảm bảo tuân thủ quy định pháp lý mà còn mang lại nhiều lợi ích cho cả nhà sản xuất và bệnh nhân:
Đảm bảo chất lượng: Công bố sản phẩm giúp đảm bảo rằng sản phẩm đạt chuẩn quốc tế và có thể sử dụng an toàn trong các quy trình y tế phức tạp như phẫu thuật mắt.
Tạo niềm tin cho người tiêu dùng: Sản phẩm đã được công bố sẽ tạo sự tin tưởng cho bác sĩ và bệnh nhân, đảm bảo rằng họ đang sử dụng các thiết bị y tế an toàn và chất lượng cao.
Mở rộng thị trường: Đối với các nhà sản xuất, việc công bố sản phẩm theo quy định không chỉ giúp lưu hành tại thị trường Việt Nam mà còn tạo điều kiện để xuất khẩu sang các thị trường khác có yêu cầu tương tự.
Kết luận
Hệ thống đặt thủy tinh thể nhân tạo là một thiết bị y tế không thể thiếu trong các ca phẫu thuật thay thủy tinh thể. Để đảm bảo an toàn và hiệu quả, việc công bố sản phẩm theo quy định của Bộ Y tế là điều bắt buộc. Quy trình này không chỉ đảm bảo tính hợp pháp của sản phẩm khi lưu hành mà còn bảo vệ sức khỏe người bệnh, tạo sự tin tưởng cho bác sĩ và mở rộng cơ hội phát triển cho các nhà sản xuất.










