Dịch vụ công bố tiêu chuẩn thuốc thử xét nghiệm định tính
Ngày 07/09/2024 - 01:09Thuốc thử xét nghiệm định tính bất thường gen bằng kỹ thuật FISH
Trang thiết bị y tế công bố tiêu chuẩn áp dụng:
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính bất thường gen bằng kỹ thuật FISH

Giới thiệu về thuốc thử xét nghiệm định tính bất thường gen bằng kỹ thuật FISH
Kỹ thuật Fluorescence In Situ Hybridization (FISH) là một phương pháp hiện đại được sử dụng rộng rãi trong chẩn đoán di truyền, đặc biệt là để phát hiện các bất thường gen và nhiễm sắc thể. Thuốc thử FISH (FISH probes) là những phân tử ADN hoặc ARN được đánh dấu bằng các chất phát huỳnh quang, cho phép xác định các vị trí cụ thể của các đoạn gen hoặc nhiễm sắc thể trong tế bào.
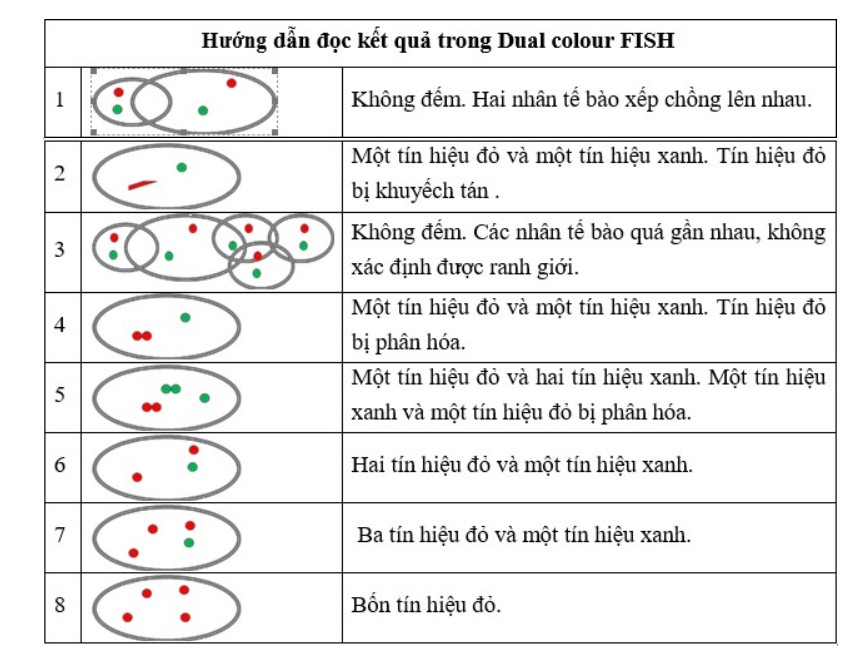
FISH là công cụ chẩn đoán mạnh mẽ trong việc phát hiện:
Đột biến gen: Giúp xác định các đột biến gen hoặc thay đổi cấu trúc gen trong tế bào.
Bất thường nhiễm sắc thể: Phát hiện các bất thường về số lượng hoặc cấu trúc nhiễm sắc thể, chẳng hạn như hội chứng Down, hoặc các đột biến liên quan đến ung thư.
Ung thư: Xác định các đột biến hoặc thay đổi di truyền liên quan đến các loại ung thư như ung thư vú, ung thư phổi, ung thư máu.
Các loại thuốc thử FISH thường được sử dụng trong chẩn đoán và nghiên cứu y học tại các phòng xét nghiệm y tế, trung tâm nghiên cứu và bệnh viện.
Vai trò của thuốc thử FISH trong y học
Thuốc thử FISH đóng vai trò quan trọng trong việc chẩn đoán các bệnh di truyền và ung thư. Khả năng định tính và định lượng chính xác các bất thường về gen và nhiễm sắc thể đã giúp cải thiện khả năng phát hiện bệnh từ giai đoạn sớm, cho phép điều trị kịp thời và hiệu quả hơn.
Chẩn đoán ung thư: FISH được sử dụng để phân tích các tế bào ung thư nhằm xác định các đột biến gen đặc hiệu giúp đưa ra phác đồ điều trị thích hợp.
Chẩn đoán bệnh di truyền: Xác định các bất thường về gen trong các bệnh lý di truyền như hội chứng Down, Turner, hoặc Klinefelter.
Hỗ trợ điều trị cá nhân hóa: Phát hiện những bất thường gen giúp thiết lập các phác đồ điều trị cá nhân hóa, tối ưu hóa hiệu quả điều trị cho từng bệnh nhân.
Thuốc thử xét nghiệm định tính DNA Streptococcus nhóm B
Trang thiết bị y tế đăng ký lưu hành:
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính DNA Streptococcus nhóm B
.png)
Thuốc thử xét nghiệm định tính DNA Streptococcus nhóm B (Group B Streptococcus, GBS) là một công cụ y tế quan trọng trong việc phát hiện sự hiện diện của vi khuẩn Streptococcus nhóm B trong mẫu bệnh phẩm. Đây là một yếu tố quan trọng trong việc chăm sóc sức khỏe bà mẹ và trẻ sơ sinh, giúp phát hiện sớm nguy cơ nhiễm trùng cho bà mẹ và thai nhi. Để đảm bảo rằng sản phẩm này được đưa ra thị trường Việt Nam một cách an toàn và hiệu quả, việc công bố sản phẩm là một bước cần thiết. Bài viết này sẽ hướng dẫn chi tiết quy trình công bố sản phẩm thuốc thử xét nghiệm định tính DNA Streptococcus nhóm B theo quy định của Bộ Y tế.
Giới Thiệu Về Thuốc Thử Xét Nghiệm Định Tính DNA Streptococcus Nhóm B
Thuốc thử xét nghiệm định tính DNA Streptococcus nhóm B được sử dụng để phát hiện sự hiện diện của DNA vi khuẩn Streptococcus nhóm B trong các mẫu bệnh phẩm, chẳng hạn như dịch âm đạo hoặc dịch tủy sống. Việc phát hiện sớm sự hiện diện của vi khuẩn này giúp bác sĩ có thể thực hiện các biện pháp phòng ngừa và điều trị kịp thời, giảm nguy cơ nhiễm trùng cho cả mẹ và bé.
Quy Định Pháp Lý Về Công Bố Sản Phẩm
Trước khi đưa sản phẩm thuốc thử xét nghiệm định tính DNA Streptococcus nhóm B ra thị trường Việt Nam, nhà sản xuất hoặc nhà phân phối cần thực hiện quy trình công bố sản phẩm theo quy định của Bộ Y tế. Quy trình này bao gồm các bước sau:
Chuẩn Bị Hồ Sơ Công Bố
Tài liệu cần thiết: Hồ sơ công bố sản phẩm phải bao gồm các tài liệu sau:
+ Mô tả sản phẩm: Cung cấp thông tin chi tiết về công thức, thành phần, quy trình sản xuất và các thông số kỹ thuật của sản phẩm.
+ Tài liệu chứng minh chất lượng và hiệu quả: Bao gồm kết quả nghiên cứu lâm sàng, thử nghiệm chất lượng, và chứng nhận từ các tổ chức có uy tín.
+ Hướng dẫn sử dụng và thông tin an toàn: Cung cấp hướng dẫn sử dụng sản phẩm một cách rõ ràng và các biện pháp an toàn cần thiết.
+ Nộp hồ sơ: Hồ sơ công bố cần được nộp cho Cục Quản Lý Dược (Bộ Y tế). Quy trình nộp hồ sơ có thể thực hiện qua hệ thống một cửa hoặc nộp trực tiếp tại cơ quan chức năng.
Xem Xét và Cấp Giấy Công Bố
+ Xem xét hồ sơ: Cục Quản Lý Dược sẽ tiến hành xem xét hồ sơ và có thể yêu cầu bổ sung thêm thông tin hoặc làm rõ một số vấn đề liên quan đến chất lượng và hiệu quả của sản phẩm.
+ Cấp Giấy Công Bố: Sau khi hồ sơ được duyệt và đáp ứng đầy đủ các yêu cầu, Cục Quản Lý Dược sẽ cấp Giấy Công Bố sản phẩm. Giấy công bố này chứng nhận rằng sản phẩm đã được kiểm tra và đủ tiêu chuẩn để lưu hành tại thị trường Việt Nam.
Thuốc thử xét nghiệm định tính RNA của SARS-CoV-2, cúm A và cúm B
Trang thiết bị y tế đăng ký lưu hành:
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính RNA của SARS-CoV-2, cúm A và cúm B
.png)
Trong bối cảnh đại dịch COVID-19 và các mùa cúm hàng năm, việc phát hiện chính xác và kịp thời các loại virus như SARS-CoV-2, cúm A, và cúm B là rất quan trọng. Thuốc thử xét nghiệm định tính RNA của SARS-CoV-2, cúm A và cúm B là công cụ quan trọng giúp xác định sự hiện diện của các virus này trong mẫu bệnh phẩm. Để sản phẩm này được phép lưu hành tại thị trường Việt Nam, việc công bố sản phẩm theo quy định của Bộ Y tế là một bước bắt buộc. Bài viết dưới đây sẽ hướng dẫn quy trình công bố thuốc thử xét nghiệm định tính RNA của SARS-CoV-2, cúm A và cúm B theo quy định của cơ quan chức năng.
Quy Trình Công Bố Sản Phẩm
Để thuốc thử xét nghiệm định tính RNA của SARS-CoV-2, cúm A và cúm B được đưa ra thị trường Việt Nam, các nhà sản xuất hoặc nhà phân phối cần thực hiện quy trình công bố sản phẩm theo quy định của Bộ Y tế. Quy trình này bao gồm các bước chính sau:
Chuẩn Bị Hồ Sơ Công Bố
Hồ sơ công bố sản phẩm cần bao gồm các tài liệu quan trọng sau:
+ Mô Tả Chi Tiết Sản Phẩm: Cung cấp thông tin chi tiết về công thức, thành phần, quy trình sản xuất, và các thông số kỹ thuật của thuốc thử. Thông tin này giúp cơ quan chức năng hiểu rõ về sản phẩm và cách thức hoạt động của nó trong việc phát hiện RNA của các virus.
+ Chứng Nhận Chất Lượng và Hiệu Quả: Bao gồm kết quả nghiên cứu, thử nghiệm lâm sàng, và chứng nhận từ các tổ chức uy tín. Các tài liệu này chứng minh rằng sản phẩm đáp ứng đầy đủ các tiêu chuẩn về chất lượng và hiệu quả trong việc phát hiện SARS-CoV-2, cúm A và cúm B.
+ Hướng Dẫn Sử Dụng và Thông Tin An Toàn: Cung cấp hướng dẫn sử dụng chi tiết và các thông tin về an toàn khi sử dụng sản phẩm. Bao gồm các biện pháp phòng ngừa và xử lý sự cố, đặc biệt là trong môi trường xét nghiệm y tế.
Hồ sơ công bố cần được nộp cho Cục Quản Lý Dược thuộc Bộ Y tế. Hồ sơ có thể được nộp qua hệ thống một cửa hoặc trực tiếp tại cơ quan chức năng.
Xem Xét và Cấp Giấy Công Bố
Cục Quản Lý Dược sẽ tiến hành xem xét hồ sơ công bố sản phẩm. Trong trường hợp cần thiết, cơ quan này có thể yêu cầu bổ sung thông tin để làm rõ các vấn đề liên quan đến chất lượng và hiệu quả của sản phẩm. Sau khi hồ sơ được duyệt và đáp ứng đầy đủ các yêu cầu, Cục Quản Lý Dược sẽ cấp Giấy Công Bố sản phẩm, xác nhận rằng sản phẩm đủ tiêu chuẩn để lưu hành tại thị trường Việt Nam.
Thuốc thử xét nghiệm định tính RNA virus SARS-CoV-2
Trang thiết bị y tế đăng ký lưu hành:
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính RNA virus SARS-CoV-2
.png)
Trong cuộc chiến chống lại đại dịch COVID-19, việc phát hiện sớm và chính xác sự hiện diện của virus SARS-CoV-2 là cực kỳ quan trọng. Thuốc thử xét nghiệm định tính RNA virus SARS-CoV-2 giúp xác định nhanh chóng sự có mặt của virus trong mẫu bệnh phẩm, góp phần quan trọng trong việc chẩn đoán và quản lý dịch bệnh. Để sản phẩm này được phép lưu hành tại thị trường Việt Nam, việc công bố sản phẩm theo quy định của Bộ Y tế là bắt buộc. Bài viết dưới đây sẽ hướng dẫn quy trình công bố thuốc thử xét nghiệm định tính RNA virus SARS-CoV-2 theo quy định hiện hành.
Quy Trình Công Bố Sản Phẩm
Để thuốc thử xét nghiệm định tính RNA virus SARS-CoV-2 được phép lưu hành tại thị trường Việt Nam, nhà sản xuất hoặc nhà phân phối cần thực hiện quy trình công bố sản phẩm theo yêu cầu của Bộ Y tế. Quy trình này bao gồm các bước chính như sau:
Chuẩn Bị Hồ Sơ Công Bố
Hồ sơ công bố sản phẩm cần được chuẩn bị đầy đủ với các tài liệu quan trọng sau:
+ Mô Tả Chi Tiết Sản Phẩm: Cung cấp thông tin chi tiết về thuốc thử, bao gồm công thức, thành phần, quy trình sản xuất, và các thông số kỹ thuật. Mô tả rõ ràng về cơ chế hoạt động của thuốc thử trong việc phát hiện RNA của virus SARS-CoV-2 là rất quan trọng.
+ Chứng Nhận Chất Lượng và Hiệu Quả: Bao gồm kết quả nghiên cứu, thử nghiệm lâm sàng, và chứng nhận từ các tổ chức uy tín, chứng minh rằng sản phẩm đáp ứng đầy đủ các tiêu chuẩn chất lượng và hiệu quả trong việc phát hiện virus SARS-CoV-2.
+ Hướng Dẫn Sử Dụng và Thông Tin An Toàn: Cung cấp hướng dẫn sử dụng chi tiết và các thông tin về an toàn khi sử dụng thuốc thử. Các thông tin cần bao gồm các biện pháp phòng ngừa, xử lý sự cố, và lưu ý khi sử dụng sản phẩm trong môi trường xét nghiệm.
Hồ sơ công bố cần được nộp cho Cục Quản Lý Dược thuộc Bộ Y tế. Hồ sơ có thể được nộp qua hệ thống một cửa hoặc trực tiếp tại cơ quan chức năng.
Xem Xét và Cấp Giấy Công Bố
Cục Quản Lý Dược sẽ tiến hành xem xét hồ sơ công bố sản phẩm. Trong trường hợp cần thiết, cơ quan này có thể yêu cầu bổ sung thông tin để làm rõ các vấn đề liên quan đến chất lượng và hiệu quả của sản phẩm. Sau khi hồ sơ được duyệt và đáp ứng đầy đủ các yêu cầu, Cục Quản Lý Dược sẽ cấp Giấy Công Bố sản phẩm, xác nhận rằng sản phẩm đủ tiêu chuẩn để lưu hành tại thị trường Việt Nam.
Thuốc thử xét nghiệm định tính kháng thể IgG kháng tiểu cầu
Trang thiết bị y tế đăng ký lưu hành:
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính kháng thể IgG kháng tiểu cầu
.png)
Xét nghiệm định tính kháng thể IgG kháng tiểu cầu là công cụ quan trọng trong việc chẩn đoán các rối loạn về huyết học, đặc biệt là trong các bệnh lý liên quan đến tiểu cầu như bệnh giảm tiểu cầu tự miễn. Để đảm bảo rằng thuốc thử xét nghiệm định tính kháng thể IgG kháng tiểu cầu đáp ứng các tiêu chuẩn chất lượng và an toàn trước khi đưa ra thị trường Việt Nam, việc công bố sản phẩm là một bước quan trọng. Bài viết dưới đây sẽ hướng dẫn quy trình công bố sản phẩm theo quy định của Bộ Y tế.
Quy Trình Công Bố Sản Phẩm
Để thuốc thử xét nghiệm định tính kháng thể IgG kháng tiểu cầu được phép lưu hành tại thị trường Việt Nam, nhà sản xuất hoặc nhà phân phối cần thực hiện quy trình công bố sản phẩm theo yêu cầu của Bộ Y tế. Quy trình này bao gồm các bước chính sau:
Chuẩn Bị Hồ Sơ Công Bố
Hồ sơ công bố sản phẩm cần được chuẩn bị đầy đủ với các tài liệu quan trọng sau:
+ Mô Tả Chi Tiết Sản Phẩm: Cung cấp thông tin chi tiết về công thức, thành phần, quy trình sản xuất và các thông số kỹ thuật của thuốc thử. Mô tả rõ cơ chế hoạt động và khả năng phát hiện kháng thể IgG kháng tiểu cầu của sản phẩm giúp cơ quan chức năng đánh giá hiệu quả và tính chính xác của sản phẩm.
+ Chứng Nhận Chất Lượng và Hiệu Quả: Bao gồm kết quả nghiên cứu, thử nghiệm lâm sàng và chứng nhận từ các tổ chức uy tín chứng minh rằng sản phẩm đáp ứng các tiêu chuẩn chất lượng và hiệu quả trong việc phát hiện kháng thể IgG kháng tiểu cầu.
+ Hướng Dẫn Sử Dụng và Thông Tin An Toàn: Cung cấp hướng dẫn sử dụng sản phẩm chi tiết và các thông tin về an toàn khi sử dụng thuốc thử. Điều này bao gồm các biện pháp phòng ngừa, hướng dẫn xử lý sự cố và lưu ý khi sử dụng sản phẩm trong môi trường xét nghiệm.
Hồ sơ công bố cần được nộp cho Cục Quản Lý Dược thuộc Bộ Y tế. Hồ sơ có thể được nộp qua hệ thống một cửa hoặc trực tiếp tại cơ quan chức năng.
Xem Xét và Cấp Giấy Công Bố
Cục Quản Lý Dược sẽ tiến hành xem xét hồ sơ công bố sản phẩm. Trong trường hợp cần thiết, cơ quan này có thể yêu cầu bổ sung thông tin để làm rõ các vấn đề liên quan đến chất lượng và hiệu quả của sản phẩm. Sau khi hồ sơ được duyệt và đáp ứng đầy đủ các yêu cầu, Cục Quản Lý Dược sẽ cấp Giấy Công Bố sản phẩm, xác nhận rằng sản phẩm đủ tiêu chuẩn để lưu hành tại thị trường Việt Nam.
Thuốc thử xét nghiệm định tính kháng thể Rh
Trang thiết bị y tế đăng ký lưu hành:
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính kháng thể Rh
Trong các xét nghiệm huyết học, việc xác định nhóm máu Rh là một yếu tố quan trọng trong nhiều ứng dụng y tế, từ việc quản lý thai kỳ đến việc truyền máu an toàn. Thuốc thử xét nghiệm định tính kháng thể Rh giúp xác định sự hiện diện của kháng thể Rh trong mẫu huyết thanh, điều này rất cần thiết trong việc chẩn đoán các tình trạng như bệnh tan máu do nhóm máu không tương thích. Để thuốc thử xét nghiệm định tính kháng thể Rh được phép lưu hành tại thị trường Việt Nam, việc công bố sản phẩm theo quy định của Bộ Y tế là một bước không thể thiếu. Bài viết dưới đây sẽ hướng dẫn quy trình công bố sản phẩm này.
Quy Trình Công Bố Sản Phẩm
Để thuốc thử xét nghiệm định tính kháng thể Rh được phép lưu hành tại thị trường Việt Nam, các nhà sản xuất hoặc nhà phân phối cần thực hiện quy trình công bố sản phẩm theo yêu cầu của Bộ Y tế. Quy trình này bao gồm các bước chính như sau:
Chuẩn Bị Hồ Sơ Công Bố
Hồ sơ công bố sản phẩm cần được chuẩn bị đầy đủ với các tài liệu quan trọng sau:
+ Mô Tả Chi Tiết Sản Phẩm: Cung cấp thông tin chi tiết về thuốc thử, bao gồm công thức, thành phần, quy trình sản xuất, và các thông số kỹ thuật. Mô tả rõ cơ chế hoạt động của thuốc thử trong việc phát hiện kháng thể Rh giúp cơ quan chức năng đánh giá hiệu quả và tính chính xác của sản phẩm.
+ Chứng Nhận Chất Lượng và Hiệu Quả: Bao gồm kết quả nghiên cứu, thử nghiệm lâm sàng và chứng nhận từ các tổ chức uy tín chứng minh rằng sản phẩm đáp ứng các tiêu chuẩn chất lượng và hiệu quả trong việc phát hiện kháng thể Rh. Các chứng nhận này cần được cung cấp từ các cơ quan có thẩm quyền và phải còn hiệu lực.
+ Hướng Dẫn Sử Dụng và Thông Tin An Toàn: Cung cấp hướng dẫn sử dụng chi tiết và các thông tin về an toàn khi sử dụng thuốc thử. Điều này bao gồm các biện pháp phòng ngừa, hướng dẫn xử lý sự cố và lưu ý khi sử dụng sản phẩm trong môi trường xét nghiệm. Việc cung cấp thông tin đầy đủ giúp đảm bảo sự an toàn và hiệu quả trong quá trình sử dụng.
Hồ sơ công bố cần được nộp cho Cục Quản Lý Dược thuộc Bộ Y tế. Hồ sơ có thể được nộp qua hệ thống một cửa hoặc trực tiếp tại cơ quan chức năng.
Xem Xét và Cấp Giấy Công Bố
Cục Quản Lý Dược sẽ tiến hành xem xét hồ sơ công bố sản phẩm. Trong trường hợp cần thiết, cơ quan này có thể yêu cầu bổ sung thông tin để làm rõ các vấn đề liên quan đến chất lượng và hiệu quả của sản phẩm. Sau khi hồ sơ được duyệt và đáp ứng đầy đủ các yêu cầu, Cục Quản Lý Dược sẽ cấp Giấy Công Bố sản phẩm, xác nhận rằng sản phẩm đủ tiêu chuẩn để lưu hành tại thị trường Việt Nam.
Các sản phẩm khác:
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên CD20
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính và định lượng các tế bào biểu hiện kháng nguyên CD4
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính và định lượng các tế bào CD3+, CD19+, CD3-CD56+
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính HLA lớp 1 C
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên CD56
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính protein PMS2
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính protein MLH1
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính protein MLH1
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính kháng thể của hệ ABO
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính kháng nguyên M
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính DNA HPV
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên Myeloperoxydase
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên HLA-DR
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên FMC7
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên CD79b
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên CD34
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên CD33
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên CD19
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên CD13
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên CD11b
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính ADN của Staphylococcus aureus
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên CD14
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên TdT
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính các tế bào biểu hiện kháng nguyên CD38
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính và bán định lượng các tế bào biểu hiện kháng nguyên CD4
- Tên trang thiết bị y tế: Thuốc thử xét nghiệm định tính tế bào biểu hiện Inhibin α
Thuốc thử xét nghiệm định tính là một sản phẩm thiết yếu trong việc chẩn đoán và theo dõi các bệnh lý. Để đảm bảo an toàn và hiệu quả, sản phẩm cần phải được công bố trước khi đưa ra lưu hành tại thị trường Việt Nam. Quy trình công bố không chỉ đảm bảo chất lượng sản phẩm mà còn bảo vệ quyền lợi của người tiêu dùng, góp phần nâng cao uy tín của các cơ sở y tế trong việc cung cấp các sản phẩm an toàn và hiệu quả.










